时间:

翻译:华溶应用中心
本篇文章提出了一种经过验证的体外释放测试方法,用于控释肠道外长效微球。使用利培酮微球验证USP4法(流池法)体外释放试验方法。进行了加速和实时释放测试。加速方法明显缩短了检测时间,并与实时释放曲线(样本分析数量有限)有良好的相关性。采用加速条件进行方法验证(耐用性和重现性)。耐用性测试结果表明,微球的释放不受流速的影响,且不受方法的微小变化(如池体装样方法、微球上样量、流通池大小和玻璃珠尺寸大小)的影响。随着温度的微小变化(±0.5℃),影响PLGA的催化降解,释放曲线显现了显著的差异。当改变系统、设备或分析人员不影响释放曲线,因此加速方法是可重复的。本工作确定了改进的药典USP 4法用于微球药物体外释放测试可能性。
用于治疗和预防各种疾病的注射用控释制剂的数量预计将进一步增加,原因如下:(1)研究新发现的多肽和蛋白药物不稳定,在胃肠道中渗透性较差;(2)基因医学正从研究转向临床,这些产品需要肠外递送;(3)药物靶向治疗变得越来越普遍(为了避免毒副作用,将昂贵的药物定位在作用部位,并将药物运送至体内其他无法到达的部位)。
注射用控释制剂有以下几种剂型,包括微球、脂质体、植入剂和药物洗脱支架。这些产品大多是通过皮下(SC)或肌肉(IM)途径注射给病人,药物在体内的释放时间长达几周或几个月时间。需要进行适当的检测,来确保控释制剂的安全性和有效性。与常规剂型不同,注射剂缺乏标准法规,特别是没有一种标准方法来进行体外释放试验,用于产品质量的常规评估和产品开发中的处方优化,以及体内外相关性(IVIVC/R)的评估。目前使用的方法有“取样分离法”和“透析法”,都未使用美国药典的官方溶出释放装置。这使得实验室间比较和监管批准审批困难。美国制药科学家协会(AAPS)、国际制药联合会(FIP)、欧洲制药科学家联合会(EUFEPS)、控释协会(CRS)、美国药典(USP)、欧洲药典(EP)、美国食品药品管理局(FDA)和欧洲药品评价机构(EMEA)举办的研讨会强调了指导控释药品体外释放试验方法的必要性,建议尽可能使用简单的方法或将其修改为新型的体外释放试验。
聚乳酸-羟基乙酸(PLGA)微球已成为最有前途的注射用控释制剂之一。自1989年以来,FDA批准了许多注射用PLGA微球产品。用于微球体外释放试验方法有“取样分离法”、“透析法”和“流池法”。然而,体外释放曲线因使用的检测条件而异。因此,这些产品需要有标准的体外放行检测方法,用于减少释放曲线的变化,并使实验室内和实验室间的方法转移成为可能。
Zolnik等人开发了一种改进的USP4法(流池法),用于实时和加速测试条件下微球的体外释放测试,并证明了USP4法相对于传统的“样品和分离”方法的优势。除了几何尺寸和操作精度(如流量、温度等)外,改进的USP 4法(流池法)方法还具有以下优点:(1)微球与释放介质可以分离;(2)可根据实验需要灵活使用不同体积的释放介质;(3)操作方便;(4)介质的蒸发量最小;(5)通过原位光纤实时监测释放过程;(6)可自动化操作。然而,需要对改良USP4法进行验证,以确保其适用于预期用途(例如作为微球质量控制的标准体外放行检验方法)。ICH-Q2A分析方法验证指南将方法的耐用性定义为方法检测能力不受参数微小变化的影响,并在正常使用期间提供其可靠性的指示。可通过在不同日期使用不同设备进行体外放行检验,并由不同分析员进行检测,测定方法重现性。
注射PLGA微球是用于长期(数天至数月)释放的药物。因此,质量控制和制剂开发需要做体外加速释放试验。然而,应建立实时和加速方法之间的关系,以证明常规质量控制检验中使用的检测方法的适用性。通过在高温或极端pH条件下增加PLGA降解(酸或碱催化的PLGA降解),可实现PLGA微球药物的加速释放。预期药物释放机制在加速释放检测期间不会发生变化,因此可在加速和实时释放曲线之间建立理想的1:1相关性。然而,在加速试验条件下(极端pH或温度),释放机制可能发生变化。这种显示不同制剂间至少存在等级顺序相关性的方法可用于质量控制。
本文介绍了一种有代表性的控释微球体外释放试验方法。使用改良的USP4(流通池)装置开发了实时和加速释放方法。验证了加速方法的稳定性和重现性,并考察了使用改良USP4装置获得的释放曲线重现性关键方法参数。本研究使用了商业化的25mg的利培酮长效微球注射剂。
2.1 材料
PLGA 65:35(MW: 95 kDa)(伯明翰聚合物公司);二氯甲烷、四氢呋喃(优级纯)和乙腈(色谱级)(赛默飞世尔科技公司,宾夕法尼亚州匹兹堡);利培酮(西格玛奥德里奇贸易有限公司,密苏里州圣路易斯、Tecoland公司,新泽西州爱迪生);聚乙烯醇(PVA)(MW: 30-70kDa)、三氟乙酸(西格玛奥德里奇贸易有限公司,密苏里州圣路易斯);所有研究均使用纯化水;利培酮微球长效注射剂(规格:25mg;批号:176921、168800、169941、9BA231、9BA237、8MA071、9MA575和8JA816;购自Ortho-Mcneil -Janssen制药,康涅狄格大学学生健康服务药房)。
2.2 方法
2.2.1 微球的制备
采用油-水(o/w)乳液萃取/蒸发技术制备了装载利培酮的PLGA微球。将1克PLGA溶于4毫升二氯甲烷中。使用均质器将300mg利培酮溶解在PLGA溶液中,转速为10,000 rpm,时间为30秒。然后将该有机相缓慢添加到20毫升1% (w/v)的聚乙烯醇(PVA)水溶液中,并在10,000 rpm下均质2分钟。将该乳液添加到250毫升0.1% (w/v)的PVA水溶液中,在25°C下以600 rpm的速度在真空下搅拌4小时。将得到的微球过滤,用去离子水洗涤三次,真空干燥24小时。制备三份微球。
2.2.2 药物和微球的表征
2.2.2.1 高效液相色谱法(HPLC) 使用高效液相色谱系统测定利培酮的浓度,紫外吸收检测器设置为275 nm。流动相为乙腈:水:三氟乙酸(25:75:0.1%,v/v/v)。安捷伦C18色谱柱 (4.6 mm×15cm),流速设置为1ml /min。进样量为30 μl。标准曲线包含预期未知(药物)浓度的80-120% (0.1 ~ 20 μg/ml)。在0.5 ~ 20 μg/ml范围内测定精密度、准确度和线性度。
2.2.2.2 测定利培酮的电离常数(pKa) 用玻璃电极(Fisher Scientific pH计)在25、40和45°C下电位滴定法测定利培酮的电离常数。在去离子水中制备0.001 M的利培酮溶液。用0.01 N盐酸(HCI)滴定25 ml利培酮溶液(0.001 M)。用Henderson-Hasselbach方程计算利培酮在不同温度下的电离常数(pKa)。所有测量都进行了三次,结果报告为平均值±标准差。
2.2.2.3 载药量 将5毫克微球溶解在10ml四氢呋喃(THF)中,采用高效液相色谱法测定利培酮浓度。载药量定义为:载药量=(载药量/微球重量)× 100。所有测量都进行了三次,结果报告为平均值±标准差。
2.2.2.4 粒度分析 使用AccuSizer 780A自稀释颗粒粒度系统测定平均颗粒直径。大约50毫克的微球分散在2毫升0.1% (w/v) PVA溶液。取200 μl分散液进行粒度分析。所有测量都进行了三次,结果报告为平均值±标准差。
2.2.2.5 玻璃化转变温度 采用Q100型差示扫描量热仪(DSC)分析了微球的玻璃化转变温度。样品从-40°C加热到100°C,冷却到-40°C,然后以20°C/min的速度再次加热到100°C。使用了第一个热循环测定微球的玻璃化转变温度(Tg)。所有测量都进行了三次,结果报告为平均值±标准差。
2.2.2.6 分子量测定 采用凝胶渗透色谱法(GPC)与蒸发光散射探测器(ELSD) 测定微球的分子量。流动相为四氢呋喃,流速为2 ml/min,温度40℃。将10mg微球溶解在10ml四氢呋喃(THF)中,并通过0.45 um过滤器后进行GPC分析。使用Waters Millenium软件进行数据收集和分析。采用聚苯乙烯标准(2000、900、824、400、200、110、43、18.80、17.60、6.93、2.61、0.98 kDa)进行校正,计算其平均分子量(Mw)。所有测量都进行了三次,结果报告为平均值±标准差。
2.2.2.7 微球降解 将10mg空白微球和利培酮微球置于6ml的pH 7.4磷酸盐缓冲液中。将试管保持在40和45±0.2℃的水浴中孵育。每24小时取出三个空白和利培酮装载微球的试管,最长4天。真空干燥24小时。使用GPC监测微球分子量变化,如第2.2.2.6节所述。
2.2.2.8 体外释放度 使用闭环系统配置12mm标准小池的流池法进行实验。在池体(12mm池体)中填充直径为1 mm的玻璃珠至1/3位置。称取大约10毫克的微球,并分成质量相等的三份。第一部分加在池体的玻璃珠上,然后盖上一小勺的玻璃珠。剩下两部分微球同样的方法加样。池体里装满玻璃珠直到池体上边缘。用防静电枪中和玻璃珠、微球和刮刀上的静电,以方便样品制备。250ml的 0.05 M pH 7.4磷酸盐缓冲液(含0.1%叠氮化钠),以8 ml/min的流速循环通过池体(装有0.45 μm再生纤维素滤膜)。为了评价该方法的耐用性,考察了较大的流速(16 ml/min),较大的玻璃珠(直径2.4-2.9 mm)和较大的池体(直径22.6 mm)。此外,并使用以下方法进行装样:(1)分两部分加入微球而不是三部分;(2)微球投样量增加50%,改变溶媒pH值为pH 6.9和7.9。流池法的温度分别维持在37±0.1℃和45±0.1℃,用于实时测试和加速测试。在加速测试中,溶媒温度变化范围为45±0.5℃。释放试验开始前,使用USP方法(USP通论<711>)对释放介质进行脱气处理。在介质瓶中使用氦气喷射进行脱气。在适当的时间间隔取样并补液,以保持漏槽条件。所有药物释放试验一式三份,报告结果为平均值+标准差。
使用商业化利培酮微球(Risperdal® Consta®)在改良的USP4(流池法)仪器上进行加速和实时体外释放试验。这些微球的载药量和粒径范围分别为38% w/w和25-150μm。本实验测定的微球载药量为39.74±0.67% (w/w)。
3.1 实时和加速释放曲线
在实时条件下(37°C)进行的商业化利培酮微球(Risperdal® Consta®)的体外释放表明,最初的突释量(24小时的释放)为1.6%,随后是约24天的迟滞期。迟滞期之后是药物释放期,从第24天到第40天(图1)。通过将温度从37℃升高到45℃进行体外加速释放试验。在加速条件下观察到约2%的突释(24小时释放)。迟滞期从37°C下的约24天显著减少到45°C下的4天。在加速条件下4天的迟滞期后是长达约7天的药物快速释放阶段。药物从微球释放的总持续时间从大约40天减少到7天(图2)。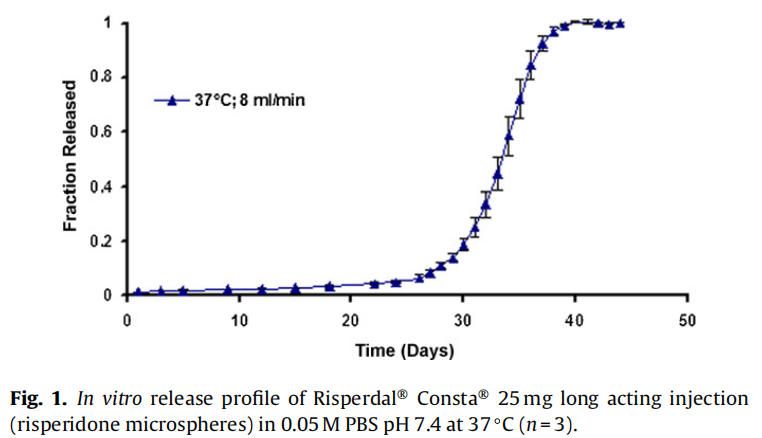
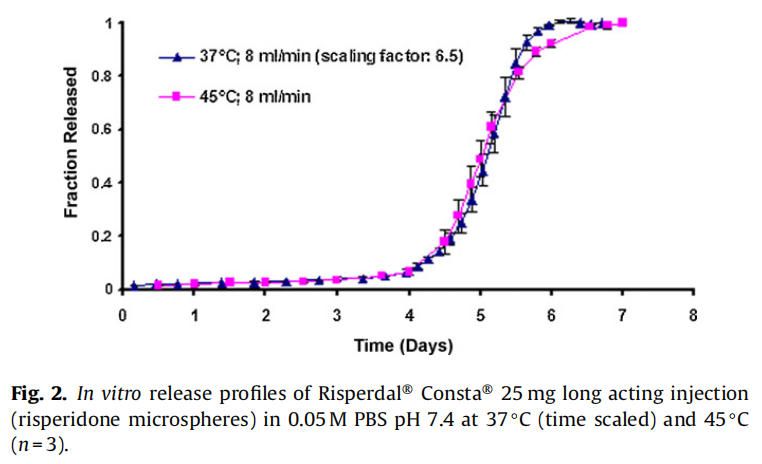
实时和加速释放曲线在同一时间轴上通过时间缩放(缩放因子6.5)进行比较。如图2所示,实时释放曲线和加速释放曲线经过时间缩放后重叠在一起。缩放因子为实时和加速释放条件下释放度为50%时的时间比值。实时条件下释放的分数与加速条件下释放的分数之间具有良好的相关性(在有限样本分析n = 3时),相关系数为0.9929(图3)。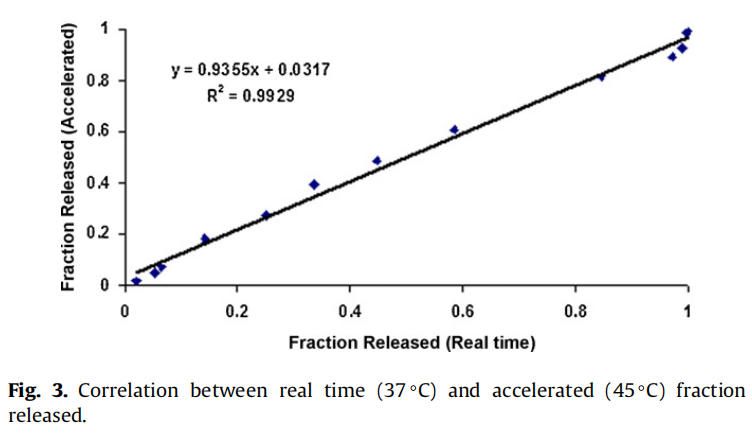
3.2 加速条件下药物释放方法的耐用性评价
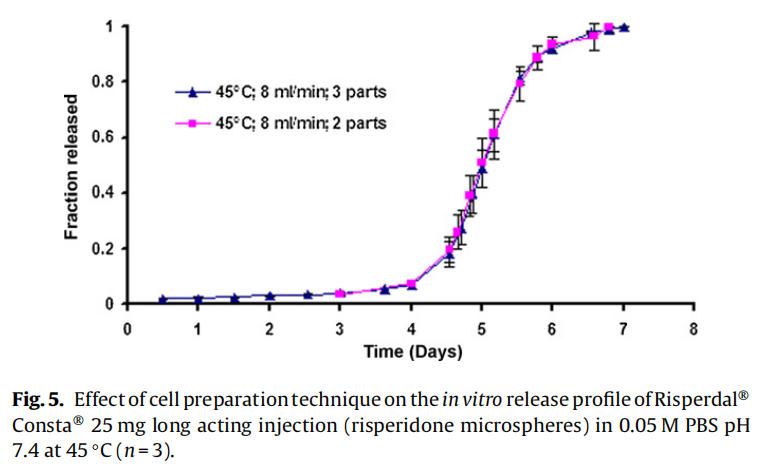
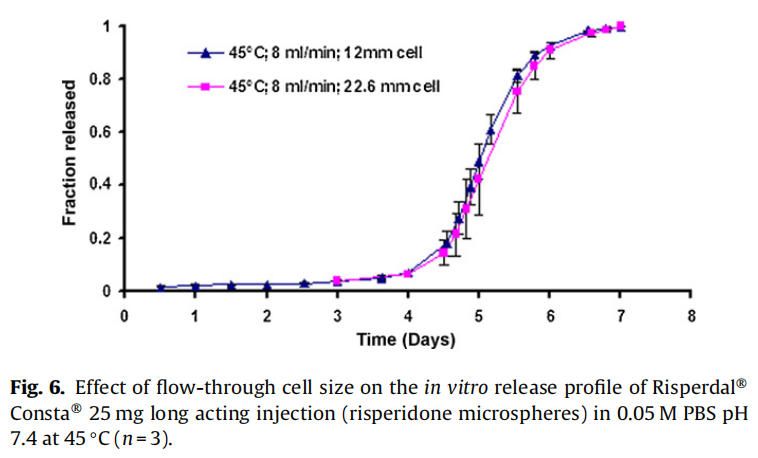
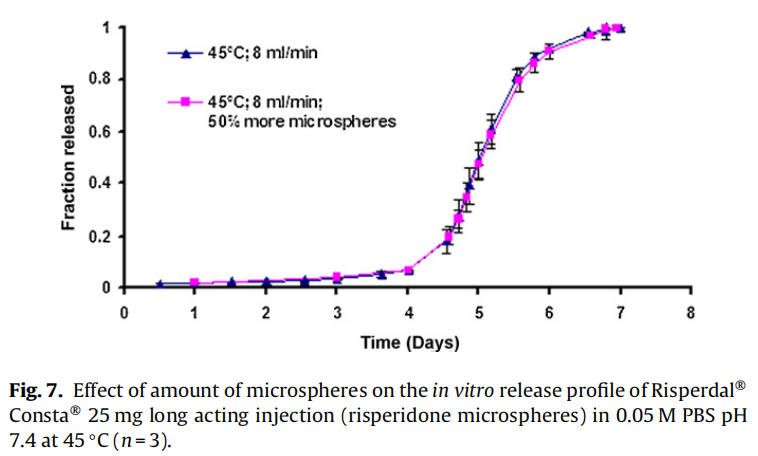
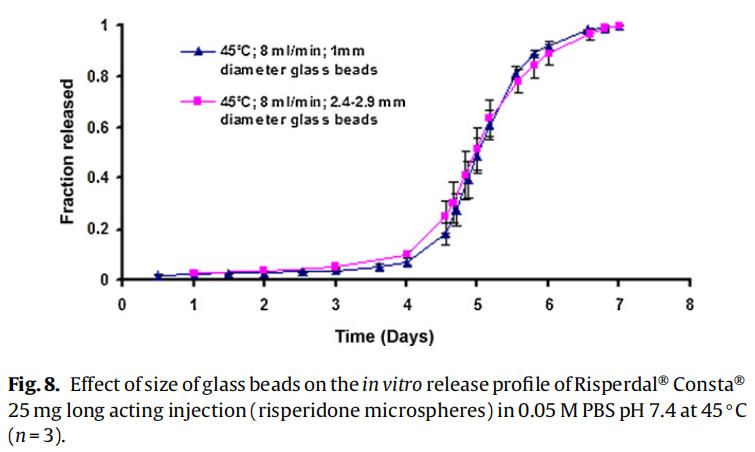
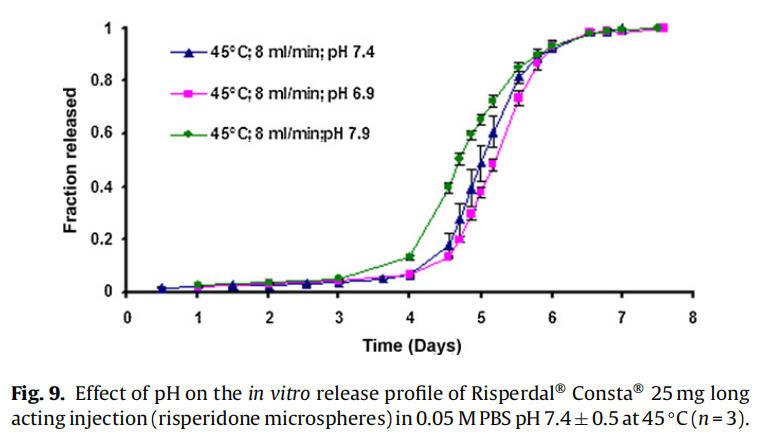
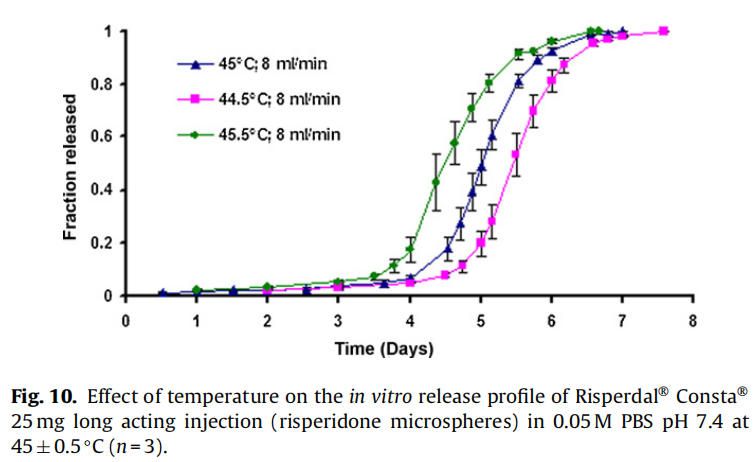
使用商业化利培酮微球对初始加速释放条件进行了耐用性测试。通过有意改变方法参数,评估药物加速释放方法的耐用性:(1)流速;(2)上样方法;(3)流通池尺寸;(4)微球上样量;(5)玻璃珠的大小;(6)释放介质pH值;(7)温度。如图4所示,微球体外释放药物不受流速(8和16 ml/min)的影响。如2.2.2.8节所述,在玻璃珠层中将微球分三等分和两等份加入,对装样方式进行了评价。结果表明池体装样方式的不同对微球的释放曲线没有影响(图5)。如图6所示,流通池的大小变化(直径12mm和22.6 mm)对释放曲线没有影响。增加50%的微球上样量,对释放曲线也没有任何影响(图7)。玻璃珠尺寸从1mm增加至2.4–2.9mm时,释放曲线无变化(图8)。释放介质(磷酸盐缓冲液)的pH降低0.5个单位(pH 7.4-6.9)时,观察到释放曲线略慢,当pH增加0.5单位(pH 7.4-7.9)时,释放曲线更快(图9)。释放温度变化±0.5◦C对微球的释放曲线有显著影响,如图10所示。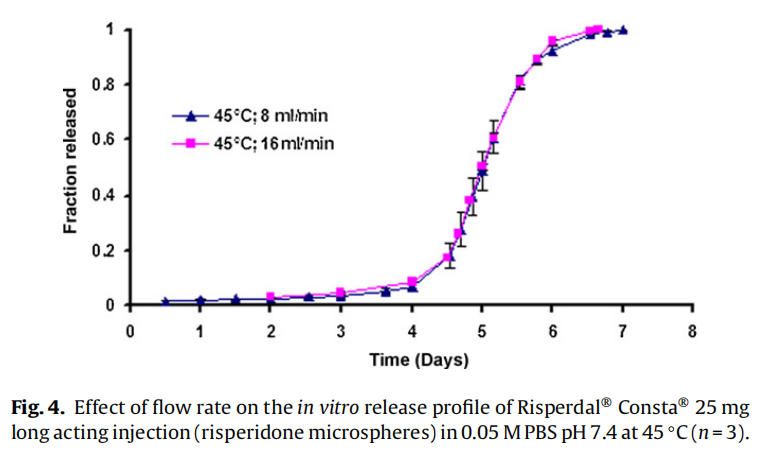
3.3 利培酮PLGA微球的温度敏感性
制备空白微球和利培酮微球(如第2.2.1节所述),以进一步研究利培酮微球的温度敏感性(图10)。95 kDa(65:35共聚物比)的PLGA用于制备微球。如表1所示,市售和自制的利培酮微球特性不同。制备的利培酮微球的平均粒径和载药量分别约为7µm和14%(w/w),而市售微球的报告粒径和载药量分别为25-150 µm和38%(w/w)。市售微球的玻璃化转变温度(约48℃)高于制备的空白微球和利培酮微球(约40℃)。然而,两种制剂(商用和制备的利培酮微球)的突释相似(如第2.2.2.8节所述测定24小时释放)(表1)。
从分子量随时间的变化可以看出,与相应的空白微球相比,制备的利培酮微球降解得更快(如图11)。与空白微球相比,制备的利培酮微球对5℃的温差下(40℃和45℃)分子量变化也更高。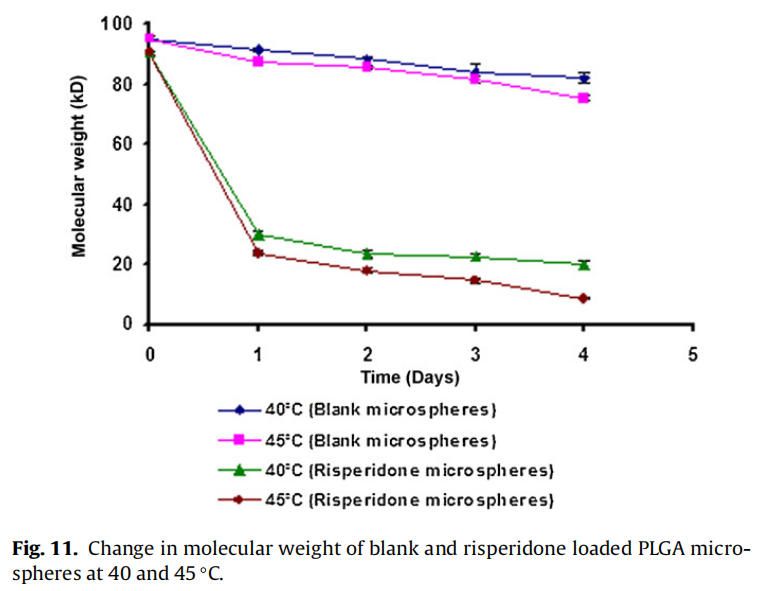
3.4 重现性检测
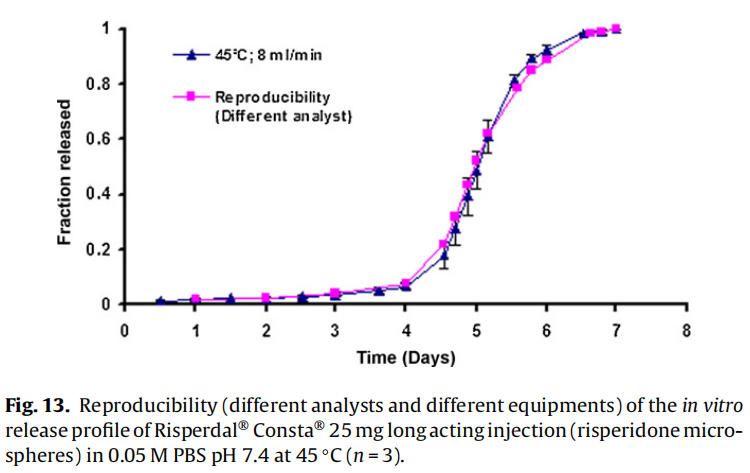
体外释放试验(使用商业化利培酮微球Risperdal® Consta®)由:(1)同一分析员使用不同USP 4法系统进行,(2)由不同分析员使用不同USP 4法系统进行,以确定方法的重现性(图12和图13)。释放曲线没有变化,表明改进的USP4法(流池法)可用于微球的体外释放试验。
商业化微球(Risperdal® Consta®)表现出较小的突释(在前24小时约1.6%),这可能是由于表面相关药物的扩散所致。在体外实时释放实验中观察到较长的迟滞期(约3周)被认为是由于聚合物侵蚀需要产生足够的孔隙来促进药物扩散和随后的释放。据报道,在滞后阶段,这些微球的聚合物分子量从90 KDa变化到20 KDa。聚合物侵蚀和药物扩散的结合被认为是高分子PLGA微球可能的药物释放机制(Zolnik et al.,2006)。因此,商业化微球(Risperdal® Consta®)的药物释放阶段(4-6周)被认为是由于聚合物侵蚀和药物扩散的结合。Ramstack等人报道,商用化利培酮微球(Risperdal® Consta®)的药物释放阶段,聚合物分子量从20 kDa下降到小于10 kDa。
加速释放测试显著减少了商业化利培酮微球(Risperdal® Consta®)释放的持续时间。实时释放曲线(37°C)和加速释放曲线(45°C)在时间缩放后重叠(图2)表明,在高温加速释放测试中并没有改变微球的药物释放机制。Zolnik等人(2006年)的工作支持了这一观察结果,他们在高温下进行的加速试验遵循侵蚀控制释放机制,并预测了37°C下的第二阶段零级释放。
对体外加速释放试验方法的耐用性和重现性进行验证。耐用性研究表明,商业化利培酮微球(Risperdal® Consta®)的药物释放不依赖于流速变化而变化(图4),这表明利培酮微球加速释放为聚合物侵蚀的控制机制。类似的结果此前也有报道,流速变化(USP4法)对高分子量(25,28和70 kDa) 地塞米松PLGA微球的释放没有影响,因为药物释放机制是聚合物侵蚀控制的。由于药物扩散控制释放机制,低分子量PLGA微球(即5 kDa)观察到流速依赖性的释放过程(Zolnik et al.,2006)。
因为这些参数可能随着分析员和实验(在不同时间进行)的变化而变化,所以考察了流通池的池体装样方法和微球装样量的微小变化。该方法对装样方法(分为两个或三个部分)和装样量有很好的耐用性(图5和图7)。评估了两种不同的流通池尺寸(即12毫米和22.6毫米直径),以确定在微球释放方法中是否需要指定池体尺寸。流通池的尺寸大小对微球的释放曲线没有任何影响(图6)。流通池的大小可以根据用于释放实验的微球的用量来选择。直径为1毫米的玻璃微珠通常用于USP4法中。有必要评估较大的玻璃珠是否对微球释放有影响,因为玻璃珠的大小可以改变微球在池体中的分布(空隙体积的变化)以及微球周围的流动模式。将玻璃珠的直径从1mm增加到2.4-2.9mm对释放曲线没有影响(图8)。直径小于1 mm的玻璃微珠没有被评估,因为它们可能会阻塞流通池的入口管路。在特定流速下,流通池大小的变化会影响池体内的流体动力学。然而,如目前工作研究,这不会影响聚合物侵蚀控制微球的释放曲线。
碱性和酸性pH均可催化PLGA降解。当介质的pH增加0.5个单位(pH7.4到7.9)时,观察到释放更快。认为这是由于OH-离子浓度增加,PLGA降解更快。当pH降低0.5单位(pH 7.4至6.9)时,释放曲线较慢,因为pH 6.9接近于中性pH,因此预期PLGA降解较慢(图9)。
微球的释放曲线对±0.5℃温度变化较为敏感(图10)。体外释放度/溶出度检测的允许温度误差范围为0.5℃(USP溶出度通则711)。然而,该温度范围 (±0.5℃)不适用于对温度敏感的利培酮微球类产品的体外放行检验。因此,需要将温度控制在±0.1℃的范围内,以获得可重现的体外释放曲线。
在微球包裹胺类药物中,如硫嘧达酮,美沙酮和奎宁,观察到胺催化的PLGA水解和随后的更快的聚合物降解。Oster等人合成了胺修饰的支链PLGA,实现了聚合物的快速降解,用于DNA的递送,发现随着聚合物胺取代量的增加,降解速率也随之增加。这种效应归因于质子化胺基团增加了水的吸收和酸催化降解PLGA酯键(Oster et al.,2004)。Maulding等解释了硫脲酮(胺类药物)催化PLGA降解的原因是N-酰基铵离子中间体的形成,该中间体易于通过酯键裂解水解(图14)(Maulding et al.,1986)。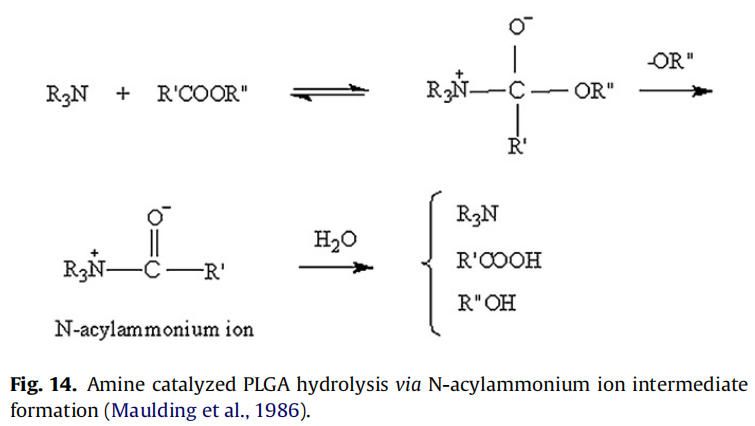
利培酮催化PLGA水解已被报道(Chue, 2003)。利培酮是一种胺类药物,与哌啶氮相关的pKa为8.18(在20°C下),如图15所示(Jug et al.,2009)。因此,在生理条件下(pH 7.4)哌啶氮的质子化可能是利培酮催化PLGA降解(酸催化降解)导致。实验测定的利培酮pKa值(电位滴定;参见第2.2.2.2节),在25、40和45℃时分别为7.89±0.01、7.64±0.02和7.56±0.01。因此,在45℃的体外释放条件下,预计利培酮中约59%的哌啶氮基团质子化(释放介质pH 7.4;pKa 7.56(45℃时))。因此,考虑到微球的高载药量(38%,w/w),在体外释放试验条件下,利培酮显著的催化PLGA降解是可能的。据推测,这种催化反应的速率随着温度的小幅升高而增加了许多倍。为证实这一假设,使用乳剂/溶剂蒸发法制备空白和利培酮微球(参见第2.2.1节)。使用共聚物比为65:35,平均分子量(Mw)为95KDa的PLGA,其与商业化利培酮微球报告的PLGA分子量相似。但与商业微球中使用的PLGA共聚物组成(Risperdal® Consta®)是不同的。与制备的空白微球和利培酮微球(~40℃)相比,商业化利培酮微球的玻璃化转变温度(Tg)较高(约48℃),表明商业化PLGA微球中乳酸含量较高。由表1可知,制备的微球粒径(约7μm)和载药量(14%,w/w)均低于市售微球。这可能是由于配方/加工条件和所用聚合物的差异造成的。商业化利培酮微球和自制利培酮微球的突释量相似。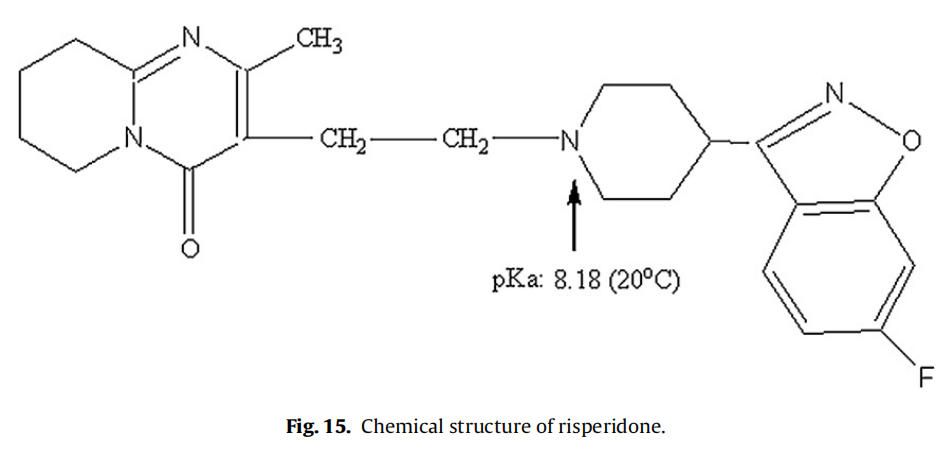
在40和45℃下,自制的利培酮微球的分子量明显比空白微球下降得更快,这与前面解释的胺催化PLGA降解的文献报道一致。与空白微球(0天约为95 kDa)相比,制备的利培酮微球的初始分子量较低(0天约为~ 90 kDa)(图11),表明发生在微球制备过程中也发生利培酮催化PLGA降解。所制备的空白微球和利培酮微球的降解率随着温度(40-45℃)的升高而增加,这是由于PLGA水解具有温度依赖性(Wu, 1995)。所制备的利培酮微球的分子量随温度升高5°C(40-45°C)而大幅度下降,这表面利培酮催化PLGA降解速率随着温度升高而显著增加的假设(图11)。所制备的利培酮微球在45°C时降解更快,尽管由于pKa的减少,7.64±0.02(40°C)到7.56±0.01(45°C),质子化基团从大约63%(40°C)略微下降到59%(45°C)。结果表明,随着温度的升高,催化降解速率的增加抵消了质子化降低约4%的影响。使用自制的利培酮微球进行降解研究(在40和45°C),载药量约为14% (w/w)。由于商业微球(Risperdal® Consta®)的载药量较高(约为38%,w/w),温度对PLGA降解的影响预计将更加明显。这种行为可能是商业化利培酮微球(Risperdal® Consta®)在±0.5°C的温差下释放曲线具有显著差异的原因(图10)。
使用USP4法测试时,将pH和释放介质温度确定为利培酮微球体外释放曲线可重现的关键参数。因此,应在体外释放试验中精确控制这些参数。然而,pH和温度效应可能因包封药物和聚合物特性(如分子量、结晶度和疏水性)而异。
除pH和温度外,还观察到溶解的空气是影响体外释放结果的关键因素(数据未显示)。虽然溶出介质的初始脱气对速释制剂的溶出度检测是有用的,但释放介质通常在长期体外释放检测中又重新溶解空气,这可能影响结果。推测微球(流通池中)捕获到气泡可能导致药物释放曲线变慢。体外释放试验期间的脱气有助于避免这种变异性。
耐用性检测结果有助于成功的重现利培酮微球的体外释放曲线。该方法具有重现性,因为更换系统/设备或分析员不会影响释放曲线(图12和13)。方法验证有助于确定改良的USP4法(流通池)作为微球体外放行检验标准方法的适用性。
改进的USP4法流通池被验证有良好的稳健性和重现性,并被证明是微球体外释放试验的合适方法。这种方法似乎适合于适当的方法转移调查后可能的药典改编。市售Risperdal®Consta®微球的加速和实时释放曲线观察到一对一的线性相关。该工作强调需要选择适当的加速测试条件,以便该方法在减少测试持续时间的同时能够预测实时释放曲线。该方法被证明是稳健的(相对于方法参数的微小变化)和可重复性的(改变设备或分析人员对释放剖面没有影响)。验证结果表明,该方法易于应用于微球体外释放试验的实验室。这项工作还提供了关于商业微球(Risperdal®Consta®)的温度敏感性的重要信息,这是以前没有报道过的。这些微球的温度敏感性是由于利培酮催化PLGA降解对温度的响应增加。这导致当测试温度改变±0.5°C时,释放曲线显著不同。因此,本研究强调需要将商业微球(Risperdal Consta®)的体外释放试验温度控制在±0.1°C的精度范围内。这种严格的温度控制预计不需要其他微球体系,除非所加入的药物与PLGA具有类似的反应性。这种方法将有助于产品开发;质量保证;以及微球配方的监管审批流程。
对改良的USP4法的稳定性和重现性进行了验证,证明其为微球体外放行检验的适当方法。这种方法似乎适合于进行方法转移。对于市售的利培酮微球的加速和实时释放曲线,观察到点对点的线性相关性。该工作强调需要选择适当的加速试验条件,以便该方法除了缩短试验持续时间外,还可预测实时释放曲线。证明该方法具有耐用性(相对于方法参数的微小变化)和可重现性(设备或分析员的变化对放行曲线无影响)。验证结果表明,该方法在微球体外释放试验的实验室中易于调整。该工作还提供了有关利培酮微球的温度敏感性的重要信息,先前尚未报告。微球的温度敏感性是由于温度升高时利培酮催化PLGA降解增加。当检测温度改变±0.5℃时,这导致释放曲线显著不同。因此,本研究强调需要将利培酮微球的体外释放检测温度控制在±0.1℃的准确度范围内。预计其他微球系统不需要进行这种严格的温度控制,除非包裹的药物与PLGA具有相似的反应特性。这种方法将有助于产品开发,质量保证,以及微球制剂的监管批准过程。
略 如需原文,请联系小编(15012941165)